|
管理员

|
[导读] 近日,美国国家过敏和传染病研究所落基山实验室(NIAID-RML)发布了一组新冠病毒在电镜下的图像。 首度曝光!新冠病毒“高清彩照”,一组图看清显微镜下的真面目 随着疫情蔓延,国内外科研机构对于病毒本身的研究也在持续深入。肆虐的新冠病毒究竟长什么样?一组彩照揭开它的“真面目”。美国国家过敏和传染病研究所落基山实验室(NIAID-RML)于当地时间13日宣布,其位于蒙大拿州的洛矶山实验室,11日在扫描和透射电子显微镜上拍摄了新冠病毒(SARS-CoV-2)的图像,清晰显示出新冠病毒用来入侵宿主细胞的棘突蛋白。  点击观看视频 视频来源:梨视频NIAID通过扫描电子显微镜和透射电子显微镜获取新冠病毒的基本图像,由视觉医学艺术办公室再对图像进行电子化上色。 落基山实验室(RML) 研究员 Emmie de Wit 博士在其研究中提供了病毒样本,显微镜学家伊丽莎白 · 菲舍尔(Elizabeth Fischer)制作了图像,RML 视觉医学艺术办公室对图像进行了数字着色。 这张图像显示了新冠病毒(SARS-CoV-2),图中的黄色部分就是导致新冠肺炎的罪魁祸首。 病毒表面的凸起,看起来就像皇冠。 图片来源:美国卫生研究院(NIH)官网此前,基因测序等研究结果显示,新出现的这种冠状病毒与SARS冠状病毒同属冠状病毒科的β属冠状病毒。 美国国家过敏与传染病研究所(NIAID)表示,从显微镜图像来看,新型冠状病毒(SARS-CoV-2)与MERS-CoV(中东呼吸综合征冠状病毒)和最初的SARS-CoV(非典,严重急性呼吸综合征冠状病毒)看起来并无太大不同。▲本期编辑:杨萌 新型冠状病毒肺炎相关科普(上下滑动查看) 生命时报公众号矩阵我们不传小道消息和谣言 我们不取吸引眼球的耸人标题我们不做只为转发量而存在的媒体 请你相信原创的力量健康路上,我们愿意陪你一起认真走下去 人民日报主管 环球时报主办微信ID:LT0385 https://new.qq.com/rain/a/20200215A0LV9V00 简介: 2月11日,美国国家过敏和传染病研究所落基山实验室(NIAID-RML),发布七张通过透射电镜制成的新冠病毒图像,清晰显示出新冠病毒用来入侵宿主细胞的棘突蛋白。 http://news.sina.com.cn/bn/world/2020-02-15/detail-iimxyqvz3092606.d.html 美实验室公布新冠病毒电镜图像 2020/02/15 13:44:56 近日,美国国家过敏和传染病研究所落基山实验室(NIAID-RML)发布了一组新冠病毒在电镜下的图像。 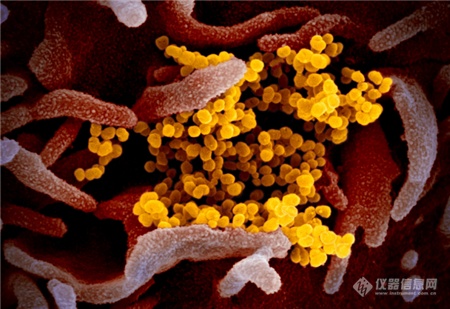 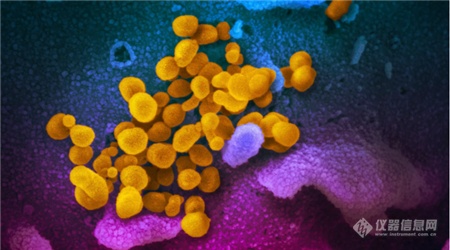 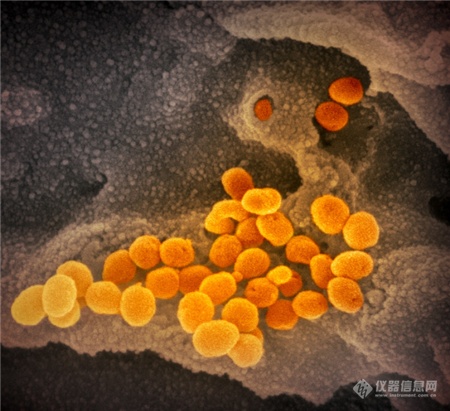 图中黄色颗粒即为新冠病毒 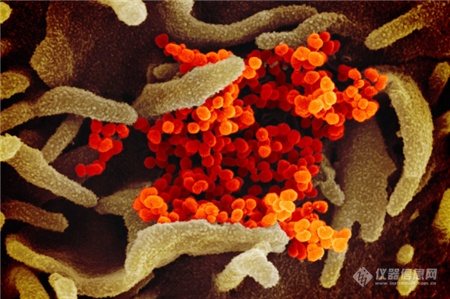 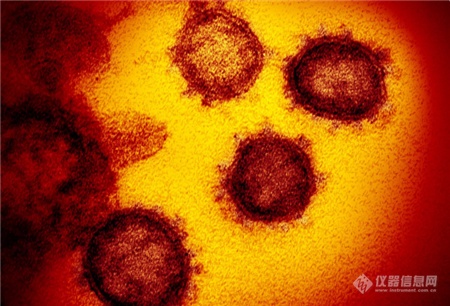 一般情况下,由于病毒太过渺小,所以很难通过一般的光学显微镜看到。本次公布的病毒图像由该研究所Emmie de Wit博士提供了病毒样本。显微镜学家Elizabeth Fischer通过扫描电镜和透射电镜获取并制作了新冠病毒的基本图像,然后实验室的视觉医学艺术办公室再对图像进行了数字着色。 研究所表示,新冠病毒与2012年出现的MERS冠状病毒及2002年出现的SARS冠状病毒非常相似。这是因为三种病毒都属于“冠状病毒”,冠状病毒因其冠状外观而得名(这在透射电镜图像中最为明显)。corona在拉丁语中即为crown(王冠)的意思。 新闻图片来源:NIAID-RML 仪器信息网 https://www.instrument.com.cn/news/20200215/521991.shtml  新冠病毒电镜图 |
|
管理员

|
沙发#
发布于:2020-02-16 17:04
|
|
管理员

|
板凳#
发布于:2020-02-17 19:13
新冠病毒为何更易传染?冷冻电镜图解病毒进入细胞的“钥匙”
澎湃新闻 发布时间:02-17 17:59澎湃新闻官方帐号 新冠病毒的传染性为何更强?科学家用“火眼金睛”的冷冻电镜技术,终于找到了其背后的原因——新冠病毒的关键刺突蛋白(S蛋白)与人体细胞的受体蛋白的亲和力,要远高于SARS-CoV。 病毒要进入人体细胞,必须找到人体细胞上相应的受体蛋白,而每个受体好比是一把“锁”,得有相应的“钥匙”才能打开,而后进入细胞内部。新冠病毒的“钥匙”就是S蛋白。 新冠肺炎疫情暴发以来,新冠病毒与宿主细胞作用的关键刺突蛋白(S蛋白,Spike glycoprotein)备受各研究团队的重视。当地时间2月15日,美国国立卫生研究院(NIH)疫苗研究中心与得克萨斯大学奥斯汀分校分子生物科学学院合作在生命科学预印本平台bioRxiv发表文章“Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation”(论文未经同行评议),对新型冠状病毒的S蛋白进行了近原子结构分析。 根据已经公开的基因组序列,研究团队合成并纯化了新型冠状病毒S蛋白的膜外部分。随后用冷冻电镜获得纯化S蛋白的3207张照片,经过3D重建,最终获得分辨率为3.5 的S蛋白三聚体结构。 通过与SARS病毒的结构比较, 研究团队认为,新冠病毒的S蛋白结合人体ACE2(宿主细胞受体血管紧张素转化酶2)的亲和力要远高于严重急性呼吸综合征冠状病毒(SARS-CoV)的S蛋白 ,这解释了为什么新冠病毒传染性要比SARS病毒强得多。 研究团队还测试了几种已发布的SARS病毒RBD特异性单克隆抗体,发现它们与新冠病毒的S蛋白没有明显的结合,这表明两种病毒RBD之间的抗体交叉反应性可能受到限制。 该论文的通讯作者为得克萨斯大学奥斯汀分校分子生物科学学院副教授Jason S. McLellan。McLellan是研究病毒的专家,此前在中东呼吸系统综合征冠状病毒(MERS-CoV)和埃博拉等病毒的结构方面做了很多非常重要的工作,包括利用冷冻电镜、X光结晶学等技术分析冠状肺炎病毒。 值得一提的是,这项研究首次提出新冠病毒S蛋白结合ACE2的亲和力要远高于SARS-CoV的S蛋白。早在1月21日和1月23日,中科院上海巴斯德研究所研究员郝沛等人、中科院武汉病毒所研究院石正丽等人均发表论文提到, 新型冠状病毒和SARS病毒一样,也是通过利用S蛋白结合人体ACE2蛋白进入细胞。不过,病毒与宿主细胞作用的关键S蛋白有更大的差异性 。 郝沛等人还利用分子结构模拟的计算方法,评估了新型冠状病毒和SARS病毒的S蛋白与人类ACE2分子相互作用的能力。结果发现,虽然新型冠状病毒的S蛋白与ACE2之间的作用力低于SARS病毒,但是仍然非常强大。“尽管新型冠状病毒的新结构与ACE2蛋白互作能力,由于丢失的少数氢键有所下降(相比SARS病毒S-蛋白与ACE2的作用有下降),但仍然达到很强的结合自由能(-50.6 kcal/mol)。” 而与之相关的病毒传染力目前也有众多团队给出数据。近日迄今为止最大规模新冠肺炎临床数据的分析认为, 衡量疾病传染能力强弱的基本传染数R0约为3.77 ,即在没有防护措施的情况下每例患者平均会传染给另外3.77人,同时强于SARS病毒的R0(2.9-3.324)。这也是迄今为止研究团队得出的新冠病毒的最高R0值。 值得一提的是,此番破解工作使用了斩获2017年诺贝尔化学奖的“冷冻电镜”。 冷冻电子显微镜,就是应用冷冻固定术,在低温下使用透射电子显微镜观察样品的显微技术,让研究者能将生物分子“冻起来”,前所未有地观察分析运动过程。这一表征对于生命化学的理解和药物学的发展都有决定性影响,使得生物化学进入一个新的时代。 新冠病毒如何入侵人体 研究团队发现,新型冠状病毒利用高度糖基化的同源三聚体S蛋白进入宿主细胞。S蛋白经历很多种结构重新排列后将病毒融合进入宿主细胞的细胞膜。这一过程包括病毒的S1亚基结合到宿主细胞受体上,引发三聚体不稳定性的发生,进而造成S1亚基脱落S2亚基形成高度稳定的融合后结构。 为了接近宿主细胞受体,S1亚基中的受体结合结构域(RBD)会经历类似铰链的构象移动从而隐藏或者暴露受体结合的关键位点。在这一过程中S1存在两种状态:“向下(down)”结构代表了受体不可结合状态,而“向上(up)”结构则代表了受体可结合状态,但同时“向上”结构较为不稳定。 图B为不同角度新冠病毒S蛋白图像,RBD“向上”原聚体以带状显示,颜色与图A相对应(绿色) 利用已经公开的新冠病毒序列的(上图A),作者们通过亲和层析和凝胶排阻层析进行体外蛋白纯化,利用冷冻电镜技术初步筛选显示出高颗粒密度的新冠病毒S蛋白图像。 通过收集和分析3207份蛋白显微影像后,作者们对蛋白进行了3D结构重组,重建了一个3.5 分辨率的不对称三聚体图像,其中一个RBD存在于“向上”结构中(上图B)。 研究团队通过使用3D可变性功能观察到了RBD类似铰链的运动,值得注意的是,这种看似随机的RBD运动已在与新冠病毒密切相关的乙型冠状病毒SARS-CoV和MERS-CoV(中东呼吸综合征冠状病毒)中被观察到,同时在与其亲属关系远一些的的甲型冠状病毒:猪流行性腹泻病毒(PEDV)的结构表征中也被捕获到。 新冠病毒为什么传染性更强 作者们将新冠病毒的结构与其他几种冠状病毒进行了比较。2019-nCoV的S蛋白整体结构与SARS病毒S蛋白的整体结构相似,各个结构之间具有高度同源性,它们之间最大的差异是RBD在其各自的“向下”结构中的位置差异。 新型冠状病毒与SARS-CoV的结构异同比较 作者们发现,与SARS病毒相比,新型冠状病毒中的RBD结构更靠近三聚体的中央部位,处于“向下”构象的SARS-CoV的RBD则与相邻原聚体的N末端域(NTD)紧贴着。 其S蛋白中3个RBD中的1个会向上螺旋突出,导致S1亚基的脱落和S2的折叠,从而使S蛋白更容易与宿主受体血管紧张素转换酶2(ACE2)结合。 另外,先前有报道发现新型冠状病毒与SARS病毒共享形同的宿主细胞受体ACE2,作者们希望进行动力学方面的检测以进一步确认两者之间的不同。 最近的报道表明,2019-nCoV的S蛋白和SARS-CoV的S蛋白有着相同的功能宿主细胞受体-血管紧张素转换酶2(ACE2),作者们通过表面等离子共振(SPR)的动力学手段量化了病毒与该受体的相互作用。 令人惊讶的是,通过表面等离子共振技术(SPR)分析得到的结果显示, 新冠病毒S蛋白与ACE2的平衡解离常数KD是15 nM,而SARS病毒S蛋白与ACE2的平衡解离常数KD达到了325.8 nM。KD值越大意味解离越多,S蛋白与ACE2的亲和力越弱。 经过计算,新冠病毒S蛋白与ACE2的亲和力,是SARS病毒S蛋白与ACE2之间亲和力10倍,甚至20倍 (上图A)。 因此,研究团队认为,可能正是新型冠状病毒S蛋白与ACE2的高亲和力,让新冠肺炎在人与人之间传播变得容易。当然,还需要进一步研究确认这个结论。 研究团队还形成了与新冠病毒的S蛋白胞外域结合的ACE2的复合物(上图B),并通过高分辨率冷冻电镜观察到,它与SARS-CoV的S蛋白和ACE2之间形成的复合物非常相似。 新型冠状病毒病毒对于ACE2具有高亲和性 这也说明,新型冠状病毒侵入宿主的机制虽然与其他的冠状病毒科的病毒相似,但传染性更强。 新冠病毒与蝙蝠冠状病毒RaTG13 除了SARS病毒之外,新型冠状病毒与蝙蝠冠状病毒RaTG13在S蛋白中序列同源性高达96%。但新型冠状病毒S蛋白最显著的不同是,其具有S1/S2蛋白酶切割位点的“RRAR”(弗林蛋白酶识别位点)氨基酸序列,而不是像SARS病毒中仅具有单个精氨酸。 新冠病毒的这一现象在流感病毒中较为普遍,其中高毒力禽流感病毒和人流感病毒常发生流感血凝素蛋白的关键位置上产生多聚弗林蛋白酶位点的氨基酸插入。 除了在S1/S2连接处的氨基酸残基差异外,新型冠状病毒和RaTG13病毒的S蛋白还存在29个氨基酸残基的差异,其中17个位于受体结合的RBD部位。 团队还分析了全球共享禽流感数据倡议组织(GISAID)数据库中的61个新冠病毒的S序列,发现在所有保存的序列中只有9个氨基酸取代。这些取代中的大多数相对保守,预计不会对新冠病毒的S蛋白结构或功能产生重大影响。 抗体实验 由于新型冠状病毒与SARS病毒之间的结构同源性且共用受体,作者们希望对已经发表的SARS病毒的RBD定向单克隆抗体(mAb)对新型冠状病毒的RBD进行交叉反应性测试。 作者们通过BLI检测试剂盒评估了SARS-CoV RBD的定向单克隆抗体S230、m396和80R的交叉反应性。 S230、m396和80R对于新冠病毒没有明显结合 但是作者们发现,尽管两病毒RBD之间结构高度相似,但是三种SARS病毒的RBD抗体在所测试的浓度(1μM)下,均未检测到与新冠病毒的RBD的结合。 研究者们认为,尽管这三种抗体的表位仅占新冠病毒的RBD表面积的一小部分,但由于观察不到结合,可以认为针对SARS病毒的的抗体对新冠病毒不一定具有交叉反应性,但新型冠状病毒S蛋白作为未来抗体分离与治疗方案的设计将提供重要参考。  澎湃新闻02-17 18:17 新冠病毒为何更易传染?冷冻电镜图解病毒进入细胞的“钥匙” |

 一键同布到我集网·各家微博
一键同布到我集网·各家微博